23 апреля
Тема: Практическая работа "Генетическая связь"
3 апреля
Тема "Ионные уравнения"
Д.з. пар.38 №5 (в,г,д), задача: рассчитайте массу продукта реакции, образовавшегося при горении 100г серы в кислороде.
1апреля
Тема "Ионные уравнения"
Д.з. пар.38 №5, задача: определите количество вещества хлорида кальция, которое можно получить из 10г кальция с хлором.
13 марта
Тема "Электролитическая диссоциация"
Д.з. пар. 36, выучить все определения
11 марта
Тема "Растворение. Растворы"
Д.з. пар. 35, №5,7
27 февраля
Тема "Реакции ОБМЕНА"
Д.з. пар. 33, №3,4, задача
25 февраля
Тема "Реакции замещения"
Д.з. пар. 32, №1,2, с.182 №1(б)
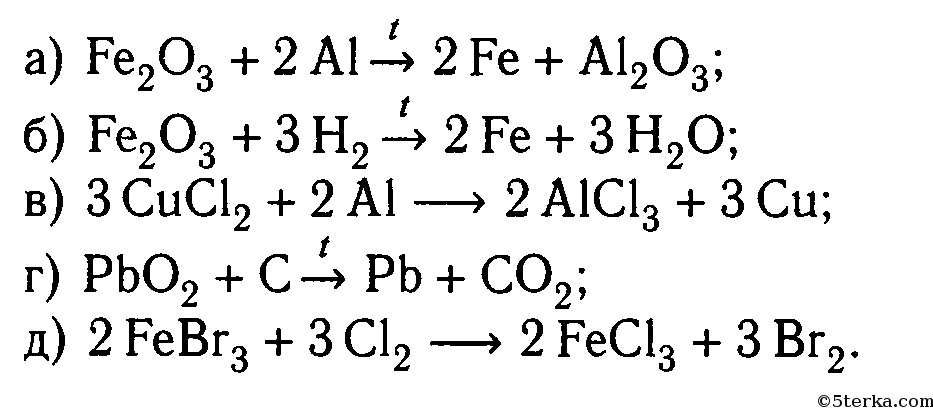
20 февраля
Тема "Реакции соединения"
Д.з. пар. 31, №1,2, задача


Пройди тестирование:
http://onlinetestpad.com/ru-ru/Go/Tipy-khimicheskikh-reakcij-5012/Default.aspx
18 февраля
Тема "Реакции разложения"
Д.з. пар. 30, №1,4,5
Посмотри интересные опыты:
http://www.youtube.com/watch?v=EXtI1MDU-og
http://www.youtube.com/watch?v=yHf-fb87Vf4
http://chaplevideo.com/video/166727309-208758086/
Реакции разложения
2AgNO3 = 2Ag + 2NO2 + O2,
(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O.
Расставьте коэффициенты:
а) Fe(OH)3 - Fe2O3 + H2O
б)Ca3(PO4)2 - CaO + P2O5
в)HNO3 - H2О + NО2 + O2
г)Cu(NO3)2 - CuO + NO2 + O2
http://learningapps.org/22807
http://files.school-collection.edu.ru/dlrstore/617fb4bc-8cff-
11db-b606-0800200c9a66/ch08_29_01.swf
13 февраля
Тема "Расчеты по химическим уравнениям"
Д.з. пар.29, задачи
Запомните алгоритм решения задачи:

2.Масса осадка, образовавшегося при взаимодействии раствора, содержащего 40 грамм сульфата меди (II) с избытком гидроксида натрия, равна_________г.
11 февраля
Тема "Химические уравнения"
Д.з.
Тема: Практическая работа "Генетическая связь"
Практическая работа.
8 класс 1 вариант
«Генетическая связь
между классами неорганических соединений»
Цель:
Оборудование:
|
Что делали
|
Наблюдения
|
Уравнения реакций
|
Вывод
|
|
|
|
|
|
Опыт №1. «Свойства соляной кислоты»
·
Налейте в пробирку 1 мл кислоты и положите 1
кусочек индикаторной бумаги. Отметьте окраску, определите среду раствора.
Запишите наблюдения и уравнение диссоциации в отчетную таблицу.
·
Налейте в пробирку 1 мл кислоты и положите 1
кусочек цинка. Запишите наблюдения и уравнения реакций в отчетную таблицу.
·
Налейте в пробирку 1 мл кислоты и положите
несколько крупинок СuO?
Нагрейте на пламени спиртовки. Запишите наблюдения и уравнения реакций в
отчетную таблицу.
·
Налейте в пробирку 1 мл NaOH, добавьте несколько капель
фенолфталеина. Что наблюдаете? Запишите уравнение диссоциации основания в
таблицу. Затем добавьте в эту пробирку 1 мл кислоты. Запишите наблюдения и
уравнения реакций в отчетную таблицу.
·
Налейте в пробирку 1 мл кислоты и добавьте 1мл
карбоната натрия. Запишите наблюдения и уравнения реакций в отчетную таблицу.
Опыт
№2. «Получение гидроксида меди(II)»
·
Налейте в пробирку 1мл сульфата меди(II) и добавьте 1 мл
гидроксида натрия. Запишите наблюдения и уравнения реакций в отчетную таблицу.
Все
уравнения записываем в молекулярном и ионном виде!!!!
Сделайте общий
вывод, в соответствии с поставленной целью.
Практическая работа.
8 класс 2 вариант
«Генетическая связь
между классами неорганических соединений»
Цель:
Оборудование:
|
Что делали
|
Наблюдения
|
Уравнения реакций
|
Вывод
|
|
|
|
|
|
Опыт №1. «Свойства соляной кислоты»
·
Налейте в пробирку 1 мл кислоты и положите 1
кусочек индикаторной бумаги. Отметьте окраску, определите среду раствора.
Запишите наблюдения и уравнение диссоциации в отчетную таблицу.
·
Налейте в пробирку 1 мл кислоты и положите 1
кусочек цинка. Запишите наблюдения и уравнения реакций в отчетную таблицу.
·
Налейте в пробирку 1 мл кислоты и положите
несколько крупинок СuO?
Нагрейте на пламени спиртовки. Запишите наблюдения и уравнения реакций в
отчетную таблицу.
·
Налейте в пробирку 1 мл NaOH, добавьте несколько капель
фенолфталеина. Что наблюдаете? Запишите уравнение диссоциации основания в
таблицу. Затем добавьте в эту пробирку 1 мл кислоты. Запишите наблюдения и
уравнения реакций в отчетную таблицу.
·
Налейте в пробирку 1 мл кислоты и добавьте 1мл
карбоната натрия. Запишите наблюдения и уравнения реакций в отчетную таблицу.
Опыт №2.
«Получение гидроксида меди(II)»
·
Налейте в пробирку 1мл хлорида железа(III) и добавьте 1 мл
гидроксида натрия. Запишите наблюдения и уравнения реакций в отчетную таблицу.
Все
уравнения записываем в молекулярном и ионном виде!!!!
Сделайте общий вывод, в соответствии с поставленной
целью.
3 апреля
Тема "Ионные уравнения"
Д.з. пар.38 №5 (в,г,д), задача: рассчитайте массу продукта реакции, образовавшегося при горении 100г серы в кислороде.
Подготовьтесь к лабораторной работе:
Лабораторная работа.
«Кислоты»
Опыт №1.
Исследуйте раствор соляной
кислоты индикатором – метилоранжем. Что наблюдаете? Запишите уравнение
диссоциации соляной кислоты.
Опыт №2.
В чистую пробирку налейте 1 мл
соляной кислоты и капните метилоранжа, добавьте 1 мл гидроксида натрия. Что
наблюдаете? Запишите уравнения реакций в ионном и молекулярном виде.
Опыт №3.
Проведите реакцию взаимодействия
соляной кислоты с металлами: цинком и медью. Запишите наблюдения и уравнения
реакций в ионном и молекулярном виде.
Опыт №4.
Проделайте реакцию взаимодействия
соляной кислоты с оксидом меди (II).
Запишите наблюдения и уравнения реакций в молекулярном и ионном виде.
Оформите результаты в таблицу:
Что делали
|
Наблюдения
|
Уравнения реакций
|
Вывод
|
1апреля
Тема "Ионные уравнения"
Д.з. пар.38 №5, задача: определите количество вещества хлорида кальция, которое можно получить из 10г кальция с хлором.
Можно решить задания из ГИА по химии, перейдя по ссылке:
Поиграйте:
13 марта
Тема "Электролитическая диссоциация"
Д.з. пар. 36, выучить все определения
11 марта
Тема "Растворение. Растворы"
Д.з. пар. 35, №5,7
27 февраля
Тема "Реакции ОБМЕНА"
Д.з. пар. 33, №3,4, задача
Типы химических
реакций.
1. Натрий
+ кислород = оксид натрия
2. Оксид
фосфора(V) + оксид
кальция = фосфат кальция + вода
3. Азотная кислота + гидроксид магния = нитрат
магния + вода
4. Карбонат
кальция = оксид кальция + оксид углерода(IV)
5. Оксид
серы(VI) + вода =
серная кислота
6. Железо
+ соляная кислота = хлорид железа(II) + водород
7. Оксид
натрия + вода = гидроксид натрия
8. Оксид
меди(II) + водород =
медь + вода
9. Сульфат
меди(II) + хлорид бария
= сульфат бария + хлорид меди(II)
10. Гидроксид
железа(III) = оксид
железа(III) + оксид
водорода
11. Азот
+ кислород = оксид азота(II)
12. Хлорид
магния + фосфорная кислота = фосфат магния+ хлороводород
13. Оксид
азота(IV)+вода +
кислород = азотная кислота
14. Железо
+ вода + кислород = гидроксид железа(III)
15. Азотистая
кислота = азотная кислота + аксид азота(II)+ вода
16. Нитрат
серебра + цинк = нитрат цинка + серебро
17. Оксид
кальция + оксид кремния = силикат кальция
18. Гидроксид
калия + фосфорная кислота = фосфат калия + вода
19. Сульфид
алюминия + вода = гидроксид алюминия + сероводород
20. Карбид
алюминия + вода = гидроксид алюминия + гидрид углерода
21. Карбонат
натрия + соляная кислота = хлорид натрия + оксид углерода(IV) + вода
22. Литий
+ азот = нитрид лития
23. Алюминий
+ серная кислота = сульфат алюминия + водород
24. Сероводород
+ кислород = оксид серы(IV)
+ вода
25. Гидроксид
меди(II) = оксид меди(II) + вода
26. Калий
+ вода = гидроксид калия + вода
27. Вода
= водород + кислород
28. Медь
+ азотная кислота=нитрат меди(II)
+ оксид азота(IV) + вода
29. Оксид
азота(II) + кислород =
оксид азота(IV)
30. Оксид
серы(IV) + вода = сернистая
кислота
Всю информацию по теме можно найти в архиве блога!!!
25 февраля
Тема "Реакции замещения"
Д.з. пар. 32, №1,2, с.182 №1(б)
| Реакции замещения – химические реакции, в которых атомы или группы атомов одного из исходных веществ замещают атомы или группы атомов в другом исходном веществе |
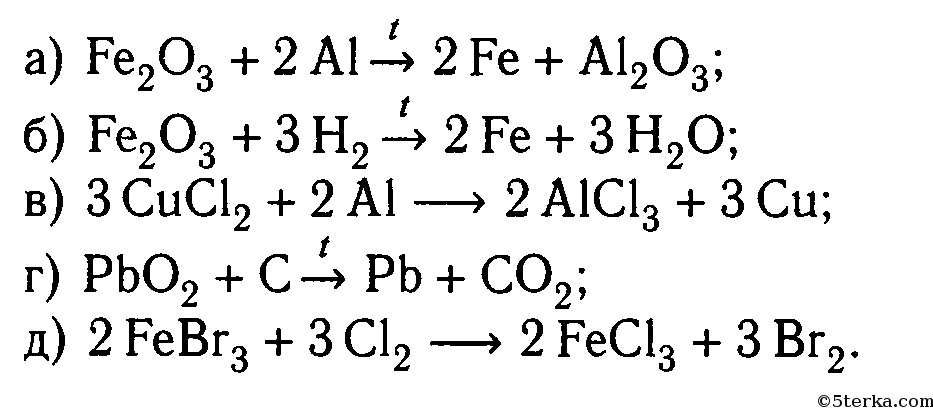
Посмотрите эксперимент и запишите уравнения реакций:
Допиши уравнения возможных реакций, используя ряд активности металлов:
Cu + H3PO4 → Fe + CuSO4 →
Al + H2SO4 → Cr + MgCl2 →
Допиши уравнения реакций, расставь коэффициенты:
Mg + HCl → MgCl2 + … Cr2O3 + Al → Cr + …
… + H2O→ Са(ОН)2 + H2 CuCl2 + Fe → … + FeCl2
20 февраля
Тема "Реакции соединения"
Д.з. пар. 31, №1,2, задача


Пройди тестирование:
http://onlinetestpad.com/ru-ru/Go/Tipy-khimicheskikh-reakcij-5012/Default.aspx
Задания для закрепления темы
№1.
Расставьте коэффициенты в уравнениях химических реакций, укажите типы химических реакции.
Уравнение реакции
|
Тип химической реакции
|
а) Al + O2 —> Al2O3
| |
б) MnO2 + H2 —> Mn + H2O
| |
в) H2O2 —> H2 + O2
| |
г) HNO3 + Fe(OH)3 —> Fe(NO3)3 + H2O
|
№2.
Допишите уравнения реакций (вместо знака вопроса впишите необходимые формулы - формулы составляйте с использованием валентностей), расставьте коэффициенты, укажите типы химических реакций.
Уравнение реакции
|
Тип химической реакции
|
а) AgI —> ?+ I2
| |
б) MgO + H2SO4 —> MgSO4 + ?
| |
в) Al + HCl —> AlCl3 + ?
| |
г) Na + Cl2 —> ?
|
18 февраля
Тема "Реакции разложения"
Д.з. пар. 30, №1,4,5
Посмотри интересные опыты:
http://www.youtube.com/watch?v=EXtI1MDU-og
http://www.youtube.com/watch?v=yHf-fb87Vf4
http://chaplevideo.com/video/166727309-208758086/
Реакции разложения
Реакции разложения приводят к образованию нескольких соединений из одного сложного вещества:
А = В + С + D.
Продуктами разложения сложного вещества могут быть как простые, так и сложные вещества.
| to | ||
| H2SiO3 | = | SiO2 + H2O. |
| to | ||
| Cu(OH)2 | = | CuO + H2O |
| to | ||
| 2SO3 | = | 2SO2 + O2. |
| to | ||
| 4HNO3 | = | 2H2O + 4NO2O + O2O. |
2AgNO3 = 2Ag + 2NO2 + O2,
(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O.
Расставьте коэффициенты:
а) Fe(OH)3 - Fe2O3 + H2O
б)Ca3(PO4)2 - CaO + P2O5
в)HNO3 - H2О + NО2 + O2
г)Cu(NO3)2 - CuO + NO2 + O2
http://learningapps.org/22807
http://files.school-collection.edu.ru/dlrstore/617fb4bc-8cff-
11db-b606-0800200c9a66/ch08_29_01.swf
13 февраля
Тема "Расчеты по химическим уравнениям"
Д.з. пар.29, задачи
Домашнее задание:
Запомните алгоритм решения задачи:
Алгоритм решения расчетных задач с использованием уравнений
химических реакций.
1. Внимательно
прочитайте текст задачи.
2. Составьте уравнения химической реакции
3.
Выпишите данные из условия задачи с соответствующими
единицами измерения (вместе с неизвестными
величинами)
в уравнение над формулами
4. Под
формулами веществ запишите соответствующие значения
этих величин, найденные по уравнению
реакции.
5.
Составляете пропорциональную зависимость и решаете ее
6.
Записываете ответ задачи.

Можно посмотреть:
Реши задачи:
1.Объем газа,выделившегося при взаимодействии раствора,
содержащего 53 грамма карбоната натрия с избытком соляной кислоты, равен
_________л.
Ответ11,2л
2.Масса осадка, образовавшегося при взаимодействии раствора, содержащего 40 грамм сульфата меди (II) с избытком гидроксида натрия, равна_________г.
Ответ:24,5г
Тема "Химические уравнения"
Д.з.
Домашнее задание:
Запишите уравнения реакций:
1)хлорид железа (III) + цинк = хлорид цинка + железо
2)азот + водород = аммиак
3)алюминий + соляная кислота = хлорид алюминия + водород
4)кальций + кислород = оксид кальция
5)сера + алюминий =
6)калий + сера=
7)натрий + хлор=
8)алюминий + соляная кислота =
9)гидроксид алюминия (III) =
Можно посмотреть и научиться:
Реши задания:
Расстановка коэффициентов
| ВАРИАНТ 1.Задание 1. Расставьте коэффициенты в приведенных ниже схемах химических реакций:
Fe + HCI → FeCI2 + H2;
NH3 → N2 + H2 ;
Fe +CI2 → FeCI3 ;
N2 + O2 → NO.
Задание 2. По алгоритму «Химическая формула»,объясните, что показывает химическая формула и произведите необходимые вычисления для вещества, состав которого выражается химической формулой: Сu2O Задание 3. Закончите уравнения химических реакций: Mg + O2 → ? Zn + CI2 → ? Задание 4. Составьте формулы веществ: Ba CI , C O , Ca N , S F , Fe O. Задание 5. Определите степени окисления атомов в веществах: Cu2O , PbO2 , CrO , Os O4 , Fe CI3. |

Комментариев нет:
Отправить комментарий